На пути к ионным сверхпроводникам: ТВЕРДЫЕ ЭЛЕКТРОЛИТЫ
Еще в конце прошлого века, в период всеобщего бума, знаменовавшего начало электрической эры, известный немецкий физик В, Нернст создал довольно необычную лампу накаливания. В ней вместо угольной или металлической нити, помещенной в вакуум или инертную атмосферу, находился открытый стерженек, изготовленный из смеси оксидов циркония и иттрия.
Это была первая, хотя и неудачная попытка применить на практике так называемые твердые электролиты — довольно необычную группу кристаллических ионных соединений, проводящих ток в результате движения ионов, а не электронов. Неудача Нернста объяснялась тем, что такую лампу приходилось зажигать … спичкой, поскольку керамический стерженек начинал проводить ток лишь при 800°С.
Тем не менее сегодня подобные нагревательные элементы (только в них вместо оксида иттрия обычно содержится оксид кальция) широко используются в технике для создания высоких температур, так как в отличие от металлических нагревателей они не только не окисляются на воздухе, но работают тем лучше, чем окислительнее среда.
И вообще, в последнее время исследованием твердых электролитов стали заниматься многие ведущие лаборатории мира, поскольку есть надежда, что с помощью ионных проводников удастся решить многие проблемы современной техники, в том числе и современной энергетики.
Но прежде разберемся в том, ПОЧЕМУ ОНИ ПРОВОДЯТ ток.
У большинства ионных кристаллов ионы каждого сорта занимают вполне определенные позиции, причем число этих позиций в точности соответствует числу имеющихся ионов. Например, в кристалле NaCl каждый ион Nа+ находится в центре октаэдра, вершины которого заняты ионами Cl—, и наоборот, каждый ион Сl—располагается в симметричном окружении шести ионов Na+ (рис. 1).
Этот жесткий порядок начинает в какой-то мере нарушаться лишь при высоких температурах, когда амплитуда колебаний ионов возрастает настолько, что некоторые частицы оказываются способными покинуть свои насиженные места в узлах кристаллической решетки и перейти в междоузлия или на поверхность кристалла (рис. 2).
Появление свободных узлов или, как говорят, ионных вакансий делает возможной ионную проводимость, которая хотя и растет с температурой, но остается достаточно малой даже близ температуры плавления — в этом смысле кристалл NaCl можно считать своеобразным ионным полупроводником. И лишь после плавления кристалла (или его растворения в подходящем растворителе) ионы обретают полную свободу.
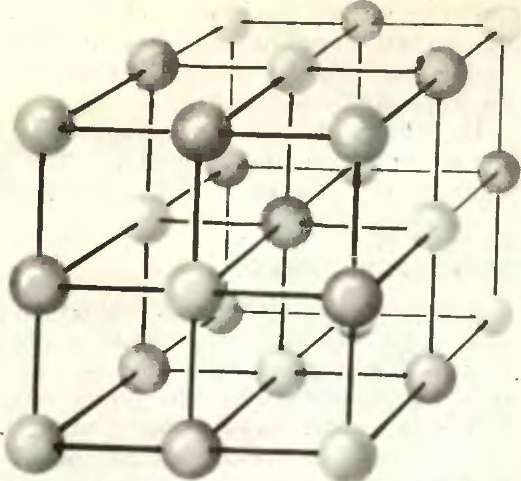
Строение ионного кристалла (например, NaCl) строго упорядочено
Иначе говоря, в кристалле возникает дефицит кислорода, появляются беспорядочно рассредоточенные по решетке кислородные вакансии, А коли так, то ионы O2- обретают повышенную подвижность, способность мигрировать по кристаллу, придавая ему тем самым способность проводить электрический ток.
Тут надо заметить интересную особенность твердых электролитов: их сходство с жидкостями. Наличие большого числа вакансий, беспорядочно расположенных в кристаллической решетке, по сути дела означает нарушение строгого дальнего порядка, характерного для настоящих твердых кристаллических тел; такое отсутствие дальнего порядка присуще, однако, жидкостям. Чем меньше порядка в той или иной подрешетке кристалла и чем подвижнее составляющие ее ионы, тем больше сходство кристалла с жидкостью, вернее не всего кристалла, а лишь одного из его компонентов.
Одним словом, твердый электролит можно представить себе в виде жесткого упорядоченного каркаса, образованного одними ионами, внутри которого находится текучая «жидкость», образованная ионами другого сорта — подобно тому, как в металлах токопроводящую «жидкость» образуют электроны. Однако если у металлов проводимость увеличивается с понижением температуры, то у твердых электролитов она растет при нагревании. А нельзя ли создать, так сказать, сверхпроводящие твердые электролиты? То есть такие кристаллические вещества, которые бы обладали исключительно высокой ионной проводимостью уже
ПРИ КОМНАТНОЙ ТЕМПЕРАТУРЕ?
Чем жестче и упорядоченнее кристаллическая решетка, образованная ионами одного сорта, и чем беспорядочнее и подвижнее ионы другого сорта, тем ниже температура, при которой может работать твердый электролит. При этом ионная жидкость, обеспечивающая электропроводность, может состоять не только из ионов кислорода, она может быть образована даже ионами металлов.
Один из уже созданных ионных сверхпроводников, способных работать при комнатной температуре, имеет состав Ag4RbI5 и получается сплавлением иодидов серебра и рубидия. Как только это соединение было открыто, оно немедленно стало применяться в качестве твердого электролита в миниатюрных твердофазных батареях, предназначенных для космоса: такая батарея, использующая энергию взаимодействия серебра с иодом, способна годами давать устойчивый ток в диапазоне температур от —55 до +75°С.
Были открыты и другие ионные сверхпроводники — такие, например, как Ag6I5WO4, Ag19I15Р2O7. Все они содержат серебро, что, конечно, значительно ограничивает возможность их широкого применения: во-первых, серебро дорого, а во-вторых, химическое сродство Ag к I невысоко, в результате чего удельная энергоемкость Ag—I-батареи почти в десять раз меньше удельной энергоемкости батареи, основанной на взаимодействии иода, скажем, с литием.
Впрочем, литий-иодная батарея существует. В ней в качестве твердого электролита используется сам LiI, способный проводить ток в результате перемещения ионов лития. Такая батарея имеет э.д.с. до 2,8 Вольта (э.д.с. Ag—I-батареи не превышает 0,7 вольта) и была бы прекрасным источником тока, если бы не слишком низкая проводимость LiI. Это вынуждает применять его в виде очень тонких пленок, что технологически крайне сложно.
Значит, нужны другие ионные сверхпроводники, пропускающие ток в результате движения ионов Li+ или, на худой конец, ионов Mg2+, Ca2+, Zn2+… Эта задача, однако, не так проста: тут мало надежды на случайный успех. Но в теории ионной проводимости еще очень много неясного, и поэтому все надежды исследователеи связаны с дальнейшим развитием теоретических представлений, способных сделать поиск целенаправленным.
Но пока ионная сверхпроводимость остается еще дразнящей приманкой, быть может, стоит изучать
НЕ ТОЛЬКО СВЕРХПРОВОДНИКИ
Свыше сорока лет назад технологи заметили, что при плавлении соды в печах, футерованных β-глиноземом, на поверхности огнеупора образуется необычная кристаллическая фаза, которую сочли за новую модификацию Al2O3 и потому назвали β-глиноземом. Позже выяснилось, что в действительности β-глинозем представляет собой соединение Na2O * nAl2O3 переменного состава (5,5 <= n <= 8,5). А советский исследователь Н. А. Торопов, изучавший это соединение еще в предвоенные годы, отметил его интересную особенность: содержащиеся в β-глиноземе ионы Na+ легко замещаются ионами других щелочных металлов, что, очевидно, связано с их аномально высокой подвижностью.
Однако прошло еще более 25 лет, пока необычные свойства β-глинозема не нашли практического применения: в 1968 году в США был выдан патент на высокоэффективную натрий-серную батарею с рекордной энергоемкостью — до 300 ватт-часов на один килограмм веса.
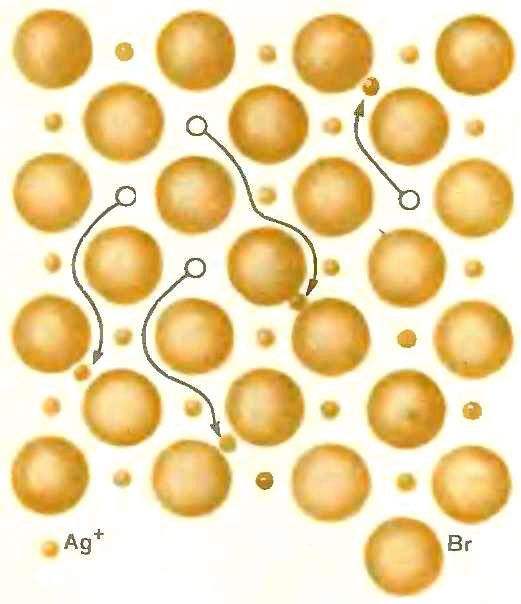
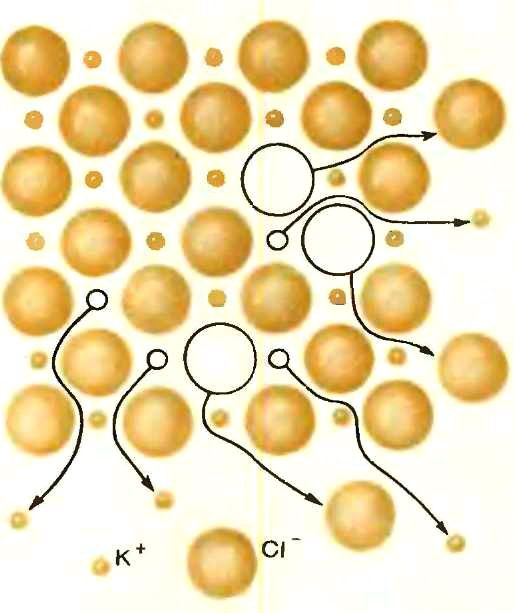
При нагревании ионного кристалла идеальный порядок начинает нарушаться, ионы переходят в междоузлия (слева)
или выводят на поверхность кристалла (справа). В результате в твердом электролите идеального порядка нет и при температурах, далеких от температуры плавления
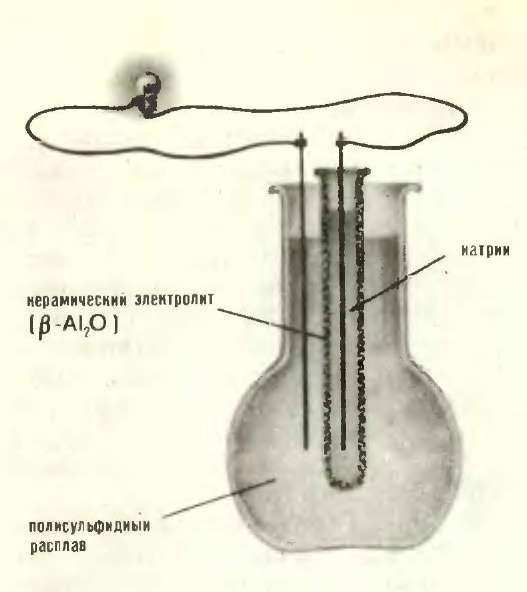
Принципиальная схема натрий-серной батареи, в которой твердым электролитом служит Na+ проводящий β-глинозем
Изобретение такой батареи сделало реальностью электромобиль, не загрязняющий внешнюю среду ядовитыми выхлопами и вместе с тем способный преодолеть расстояние в 500-600 км со средней скоростью 70 км/час.
К сожалению, у Na—S-батарей есть один крупный недостаток: поскольку в результате реакции образуются сравнительно высокоплавкие сульфиды натрия, батарея работает лишь при 300°С, и ее надо либо постоянно поддерживать в сильно нагретом состоянии, либо тратить на стартовый разогрев много времени. Увы, несмотря на отдельные успехи, идеальная батарея не создана до сих пор, и виной тому — сравнительно ограниченный выбор твердых электролитов, обладающих достаточной проводимостью нужного типа при не слишком высоких температурах.
Поэтому, естественно, во всех технически развитых странах идет поиск новых электрохимических систем, не обладающих недостатками натрий-серной батареи, но имеющих не меньшую энергоемкость. Работы по созданию новых твердых электролитов — в том числе и на основе β-глинозема — ведутся, в частности, на химическом факультете Московского государственного университета при участии автора статьи. С помощью разработанного здесь метода криосинтеза * удалось создать модификации β-глинозема, в которых проводимость обусловлена ионами Li+, К+, Rb+, Cs+, Тl+, Аg+, Ga+, NO+, NH4+, Cu+ — целое семейство разнообразных ионных проводников. Когда же твердые электролиты окончательно перестанут быть экзотикой, это откроет перед техникой буквально
ФАНТАСТИЧЕСКИЕ ВОЗМОЖНОСТИ
Не так давно у β-глинозема было обнаружено еще одно необычное свойство: оказалось, что его проводимость существенно зависит от давления водорода в окружающей среде. Хотя природа этого явления еще не выяснена, на его основе были немедленно созданы чувствительные детекторы водорода, крайне необходимые, например, в химической промышленности. Говоря о водороде, нельзя не упомянуть о научно-технической проблеме, которая сейчас оживленно обсуждается, — о переводе энергетики с электричества на водород. Суть ее заключается в том, что энергию, полученную тем или иным способом, можно использовать для разложения воды на кислород и водород; последний можно практически без потерь транспортировать по трубам на далекие расстояния.
Существующие топливные элементы, дающие электрический ток в результате взаимодействия водорода с кислородом, основаны на применении жидких электролитов, что существенно снижает возможность их широкого использования — несравненно больший эффект сулит применение твердых кислородпроводящих электролитов.
Но еще заманчивее создать твердые электролиты, проводящие электрический ток в результате движения ионов водорода — протонов. Не говоря уже о том, что такие электролиты можно было бы использовать в тех же топливных элементах, их можно было бы использовать вместо труб, для транспортировки водорода в виле ионов, Подумайте только: тогда бы водородное топливо можно было передавать подобно обычной электроэнергии — по проводам, изготовленным из такого протон-проводящего твердого электролита!
Но возможности применения твердых электролитов не ограничиваются только энергетикой.
Известно, что граница раздела между разнородными материалами обладает особыми свойствами. Это в полной мере относится и к границе раздела между твердым электролитом и электронным проводником.
Например, если на поверхность кристалла Ag4RbI5 нанести платиновые или графитные контакты и наложить внешнее электрическое поле, то через раздел фаз ток идти не будет, поскольку графит или платина блокируют движение ионов Ag+, а кристаллы Ag4RbI5 — движение электронов. В результате на границе раздела будет накапливаться электрический заряд, образованный ионами Ag+ с одной стороны и электронами — с другой.
Иначе говоря, такая система способна служить электрическим конденсатором. Причем, поскольку расстояние между обкладками такого конденсатора может быть доведено до расстояния между атомами, он способен иметь феноменальную емкость.
Способность ионных проводников пропускать только ионы можно использовать и иначе. Если на кристалл Ag4RbI5 нанести два серебряных электрода, то при пропускании тока масса одного электрода станет убывать, а другого — увеличиваться в точном соответствии с количеством прошедшего электричества. И поэтому подобная система может быть использована для очень точных электрических измерений, а также для создания интегральных элементов памяти.
А если на тот же кристалл нанести электроды, один из которых серебряный, а другой — платиновый, то в результате пропускания тока в одном из направлений серебро будет переноситься через твердый электролит и откладываться на платине в количестве, пропорциональном количеству прошедшего электричества. Если же внешний источник тока отключить и замкнуть цепь, то в системе возникнет ток противоположного направления, и этот ток будет идти до тех пор, пока с платины не удалится все осажденное серебро. Так можно создавать автоматические переключающие устройства с периодами переключения тока от нескольких секунд до нескольких месяцев.
Многие свойства твердых электролитов до сих пор остаются тайной, и трудно сказать, как скоро они будут познаны до конца. Но игра, как говорится, стоит свеч: ионным проводникам предстоит рано или поздно совершить переворот во многих наших представлениях о возможностях химических источников тока.
Доктор химических наук Ю.Д.ТРЕТЬЯКОВ
опубликовано в журнале «Химия и Жизнь» №2 за 1978
Эти и подобные исследования, в итоге, вылились в соpдание датчика кислорода , которые начали использоваться в системах управления двигателями для контроля содержания кислорода отработавших газах с целью формирования стехиометрической смеси и снижения нагрузки на катализаторы.
Но все равно в процессе эксплуатации катализаторы выходят из строя и требуют замены или удаления. Для обеспечения корректной работы блоков управления, при удалении или отказе катализатора требуется установка эмулятора катализатора.
http://mobileelectronics.com.ua/wordpress/%d0%bd%d0%b0-%d0%bf%d1%83%d1%82%d0%b8-%d0%ba-%d0%b8%d0%be%d0%bd%d0%bd%d1%8b%d0%bc-%d1%81%d0%b2%d0%b5%d1%80%d1%85%d0%bf%d1%80%d0%be%d0%b2%d0%be%d0%b4%d0%bd%d0%b8%d0%ba%d0%b0%d0%bc/СтатьиДатчики кислородаP0420,P0430,неэффективность катализатора,обманка катализатора,эмулятор катализатораЕще в конце прошлого века, в период всеобщего бума, знаменовавшего начало электрической эры, известный немецкий физик В, Нернст создал довольно необычную лампу накаливания. В ней вместо угольной или металлической нити, помещенной в вакуум или инертную атмосферу, находился открытый стерженек, изготовленный из смеси оксидов циркония и иттрия. Это была первая, хотя...fordmaxfordmax fordmaxtrackme.org@gmail.comAdministratorMobileSoft - GPS мониторинг Системы Безопасности Разработка и производство РЭА

